Reacție Boudouard
Reacția Boudouard, denumită după Octave Leopold Boudouard, este o reacție redox ce implică un echilibru chimic a unui amestec de monoxid de carbon și dioxid de carbon, la o anumită temperatură. Este de fapt o reacție de disproporționare a monoxidului de carbon în dioxid de carbon și grafit, sau inversul acestui proces:[1]
- 2CO Format:Eqm Format:Chem + C
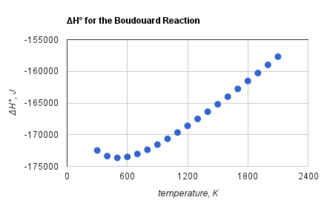
Reacția Boudouard formează dioxid de carbon și carbon și este exotermă la orice temperatură. Cu toate acestea, entalpia standard a reacției Boudouard devine mai puțin negativă odată cu creșterea temperaturii,[2] după cum se observă în imagine.
În timp ce entalpia de formare a Format:Chem (−393,509 kJ/mol) este mai mare decât cea a Format:Chem (−110,525 kJ/mol), entropia de formare este mult mai mică. În consecință, energia liberă standard de formare a Format:Chem din elementele sale componente este aproape constantă și independentă de temperatură, în timp ce energia liberă de formare a Format:Chem scade odată cu temperatura.[3] La temperaturi ridicate, reacția directă devine endergonică, favorizând reacția inversă (exergonică), chiar dacă reacția directă este încă exotermă.
Efectul temperaturii asupra reacției Boudouard este mai bine reprezentat de valoarea constantei de echilibru decât de energia liberă standard de reacție. Valoarea log 10(K eq) pentru reacție în funcție de temperatură în Kelvin (pentru valori între 500-Format:Val K) este de aproximativ: [4]
Format:Math are valoarea zero la Format:Val K.
Aplicații
Inversa acestei reacții este studiată pentru folosirea în pile de combustie care să permită oxidarea electrochimică directă a cărbunelui[5].
Note
Legături externe
- ↑ Bioenergylist.org – Boudouard Reaction spreadsheet
- ↑ Reaction Web
- ↑ Format:Ill-wd
- ↑ Based on a regression of values from the Reaction Web reference. This equation gives quite accurate values even though RT2 times its derivative does not give an accurate formula for ΔH, which it should do.
- ↑ Format:Citation