Halohidrină
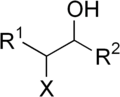
În chimia organică, o halohidrină (denumită și haloalcool sau β-haloalcool) este grupă funcțională în care un atom de halogen și o grupă hidroxil sunt legate de doi atomi de carbon adiacenți.[1] Termenul face referire la compuși saturați, astfel că 2-clorofenolul nu ar fi considerat a fi o halohidrină.
Obținere
Din alchene
Halohidrinele sunt de obicei preparate în urma reacției dintre o alchenă și un halogen, în prezența apei.[2] Reacția este o formă de adiție electrofilă, similară cu reacția de adiție a halogenilor, și are loc prin intermediul unui mecanism de reacție de anti-adiție (grupele X și OH nou formate se vor afla în configurație trans). De exemplu, ecuația reacției de conversie a etilenei la clorohidrina etilenei este:
Pe de altă parte, când se dorește realizarea unei reacții de bromurare, se utilizează N-bromosuccinimida (NBS) în locul bromului, deoarece astfel se formează mai puțini produși secundari:

Din epoxizi
Halohidrinele mai pot fi obținute în urma reacției dintre un epoxid și un hidracid al unui halogen sau o halogenură metalică.[3]
Reacția este implementată la nivel industrial pentru obținerea unor clorohidrine care sunt precursori pentru epoxizi importanți, precum sunt epiclorohidrina și oxidul de propilenă. În trecut, 2-cloroetanolul era produs pe scară largă ca precursor pentru oxidul de etilenă, dar în prezent este preparat prin oxidarea directă a etilenei.[4]
Pentru obținerea oxidului de propilenă, procesele care au loc sunt următoarele:
Din 2-cloroacizi
Proprietăți chimice
Halohidrinele suferă reacții de substituție de tip SN2 în prezența bazelor (hidroxid de calciu, hidroxid de potasiu), formând epoxizi. Acest proces de epoxidare poate fi considerat a fi o variantă a sintezei Williamson pentru eteri. De exemplu, plecând de la clorohidrina propilenei se obține oxidul de propilenă, reacția fiind cel mai frecvent utilizată pentru obținerea acestui compus:[5]

Note
- ↑ Format:GoldBookRef
- ↑ Format:Cite web
- ↑ Format:Cite journal
- ↑ Format:Ullmann
- ↑ Dietmar Kahlich, Uwe Wiechern, Jörg Lindner “Propylene Oxide” in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. Format:DOI Article Online Posting Date: June 15, 2000

